27 Juin Santé : le corps sous protection
Thérapies de rupture cardiaques : à la croisée de quatre approches pionnières : réels potentiels ou utopies ?
L’insuffisance cardiaque est un problème de santé publique car c’est une pathologie fréquente (800 000 patients en France) et grave. En effet, sa mortalité est élevée (plus de 200 000 morts par an en France, avec une mortalité intrahospitalière de 8 % et une mortalité à 5 ans de 60,3 %). De plus, elle est à l’origine de nombreuses hospitalisations (216 000 hospitalisations en 2012 en France) et de réhospitalisations (45,1 % en 2012) avec, de ce fait, un coût financier considérable (1,6 milliard d’euros en 2007, en France).
Incontestablement, la médecine régénératrice constitue un champ de recherche en plein essor, particulièrement dans ses applications cardiaques. Le marché européen, voire mondial, est marqué ces dernières années par une frénésie évidente autour du développement de thérapies cardiaques régénératives. Depuis plusieurs mois, quelques acteurs émergent et bouleversent le secteur, à commencer par les sociétés médicales Carmat, Cardio 3 Biosciences et CellProthera.
Tandis que tous les regards se tournent vers chacune d’elles et leurs avancées, comment s’y retrouver ? Quels sont leurs dénominateurs communs ? Quelles sont leurs divergences manifestes ? Leurs approches thérapeutiques sont-elles foncièrement opposées ou complémentaires dans le traitement de l’insuffisance cardiaque ?
Dans 24 à 36 mois, les trois sociétés devraient commercialiser leurs premiers dispositifs et solutions curatives. Aussi, il s’avère essentiel de bien appréhender les enjeux qui en découlent et de distinguer chaque thérapie régénérative.
L’insuffisance cardiaque reste la première cause de mortalité dans le monde. Les maladies cardiovasculaires dans leur ensemble représentent un tiers des décès planétaires. Plus de 20 millions de personnes en mourront cette année en Europe et Amérique du Nord !
Les cellules souches
 Face à ce véritable enjeu de santé publique, certaines études encourageantes ont notamment démontré l’extrême potentiel des cellules souches. Contrairement aux cellules de la peau, du foie ou de l’os, par exemple, celles du muscle cardiaque se renouvellent peu et leurs capacités d’auto-réparation diminuent avec l’âge. La mort des cellules après un infarctus du myocarde conduit à la destruction quasi définitive de la partie du cœur touchée, d’où l’intérêt des études de médecine régénérative.
Face à ce véritable enjeu de santé publique, certaines études encourageantes ont notamment démontré l’extrême potentiel des cellules souches. Contrairement aux cellules de la peau, du foie ou de l’os, par exemple, celles du muscle cardiaque se renouvellent peu et leurs capacités d’auto-réparation diminuent avec l’âge. La mort des cellules après un infarctus du myocarde conduit à la destruction quasi définitive de la partie du cœur touchée, d’où l’intérêt des études de médecine régénérative.
Les cellules souches que l’on greffe tentent de régénérer un organe endommagé ou détruit en sécrétant, elles aussi, des substances réparatrices dont certaines commencent à être identifiées.
 La greffe de cellules souches qui ont deux caractéristiques principales. 1. La capacité de se multiplier. 2. Quand elles sont embryonnaires, elles peuvent se transformer en cellules de n’importe quel organe. Les cellules souches adultes sont plus “spécialisées”. Ainsi, seules les cellules souches embryonnaires peuvent donner de nouvelles cellules du cœur. C’est à ce stade très précoce du développement qu’elles ont la plasticité nécessaire pour se différencier en de multiples types cellulaires (cœur, cerveau, œil, etc.). A l’hôpital européen Georges-Pompidou de Paris, la première étude d’implantation de cellules souches embryonnaires a été réalisée au cours d’un pontage coronaire. Elles ont au préalable été traitées pour devenir des cellules cardiaques dans le laboratoire de thérapie cellulaire de l’hôpital Saint-Louis (Pr Larghéro et Dr Vanneaux). Le premier objectif de l’essai est de vérifier la sécurité de ce type de greffe.
La greffe de cellules souches qui ont deux caractéristiques principales. 1. La capacité de se multiplier. 2. Quand elles sont embryonnaires, elles peuvent se transformer en cellules de n’importe quel organe. Les cellules souches adultes sont plus “spécialisées”. Ainsi, seules les cellules souches embryonnaires peuvent donner de nouvelles cellules du cœur. C’est à ce stade très précoce du développement qu’elles ont la plasticité nécessaire pour se différencier en de multiples types cellulaires (cœur, cerveau, œil, etc.). A l’hôpital européen Georges-Pompidou de Paris, la première étude d’implantation de cellules souches embryonnaires a été réalisée au cours d’un pontage coronaire. Elles ont au préalable été traitées pour devenir des cellules cardiaques dans le laboratoire de thérapie cellulaire de l’hôpital Saint-Louis (Pr Larghéro et Dr Vanneaux). Le premier objectif de l’essai est de vérifier la sécurité de ce type de greffe.
Les substances régénératrices sécrétées par les cellules souches prendront sans doute leur place dans l’arsenal thérapeutique. Mais, pour rester prudents, cette médecine n’accomplira pas de miracles. Elle contribuera cependant à améliorer le pronostic de nombreuses maladies, en association avec d’autres traitements, existants ou en développement. (Source : Propos du Pr Philippe Menasché, Chirurgien cardiaque, codirecteur d’une équipe Inserm (thérapie cellulaire des maladies cardio-vasculaires, hôpital européen Georges-Pompidou) – Interview ParisMatch 17 juin 2014)
Un besoin médical considérable
En sus des problèmes éthiques qui y sont liés, l’utilisation de cellules souches embryonnaires pose encore bien des problèmes techniques non résolus qui en limitent leurs applications. C’est pourquoi, dans le domaine cardiaque, seules des cellules souches adultes ont été utilisées à ce jour dans les essais thérapeutiques.
Aujourd’hui, il est donc primordial de séquencer les indications des différents traitements à l’étude, puis d’en dégager les avantages et inconvénients respectifs. Ils interviennent à différents stades de l’insuffisance cardiaque (IC), post-infarctus ou non, leur but étant de rétablir la fonction cardiaque à des degrés distincts. Malgré leurs divergences et approches apparemment antinomiques, ces thérapies semblent néanmoins complémentaires…
CARMAT – Un traitement patent bientôt dépassé ?
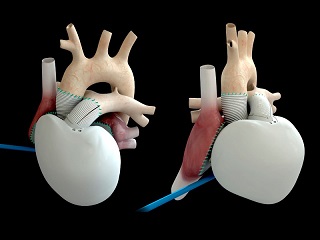 Le positionnement de Carmat est à restituer dans ses indications et applications premières. Dans le cadre du traitement de l’insuffisance cardiaque, son dispositif a pour vocation de pallier le manque notoire de greffons et les problèmes d’éligibilité à la transplantation. Le cœur artificiel est indiqué pour le traitement de l’insuffisance cardiaque chronique (ICC) en phase avancée, voire terminale.
Le positionnement de Carmat est à restituer dans ses indications et applications premières. Dans le cadre du traitement de l’insuffisance cardiaque, son dispositif a pour vocation de pallier le manque notoire de greffons et les problèmes d’éligibilité à la transplantation. Le cœur artificiel est indiqué pour le traitement de l’insuffisance cardiaque chronique (ICC) en phase avancée, voire terminale.
Sa principale originalité, par rapport aux précédents cœurs artificiels, est de pouvoir s’adapter aux changements de rythme de vie du patient, lui permettant de retrouver un niveau de fonctionnalité cardiaque acceptable en (presque) toutes circonstances, sans le contraindre à un système trop lourd.
Néanmoins, dans sa configuration actuelle, le cœur artificiel de Carmat pèse encore 900 grammes, contre 300 grammes pour un organe naturel, et nécessite toujours d’être relié à une batterie externe, dont l’autonomie reste limitée à 12 heures. Autrement dit, pour accueillir un tel dispositif, les patients éligibles doivent présenter une certaine « robustesse » anatomique. En conséquence, seul un malade sur cinq disposant d’un torse assez large pour l’implantation, peut accueillir la prothèse de Carmat, ce qui rend actuellement improbable l’implantation chez la plupart des femmes.
Assurément, cette technique, indépendamment de la récente actualité de la société, incarne une véritable prouesse technologique et l’aboutissement de 20 années de recherche. Toutefois, elle arrive sans doute un peu tard au regard des promesses de la médecine dite « régénératrice ».
Les thérapies cellulaires en cours de développement démontrent en effet chaque jour un peu plus leur potentiel et avancées. En cardiologie, si elles tiennent leurs promesses, elles vont sérieusement tarir à moyen terme le « réservoir » de patients présentant une insuffisance cardiaque terminale. Mais pour l’heure, le problème ne se pose pas encore en ce sens à Carmat, dont le dispositif révolutionnaire présente l’avantage majeur de pouvoir pallier le manque criant de donneurs pour une transplantation cardiaque dans tous les pays, peut-être dans l’attente de nouveaux traitements.
Chaque année, en effet, des milliers de malades décèdent par manque de donneurs d’organes. Actuellement, seuls 350 à 400 patients, en insuffisance cardiaque terminale, peuvent être transplantés en France, tandis que le besoin est trois fois supérieur. Le niveau fixé par Carmat, d’implanter chaque année près de 1 000 à 2 000 patients, reste donc un objectif ambitieux , si la société parvient à l’atteindre. L’essai de faisabilité en cours, mené encore sur trois autres patients « au pronostic vital engagé », constitue un véritable espoir pour les patients actuels mais, sur le long terme et à grande échelle, offre des perspectives plus modestes.
Car, bien que le traitement de Carmat ne nécessite pas l’administration à vie de médicaments immunosuppresseurs, le dispositif conserve un niveau de prise en charge élevé, le coût estimé à ce jour de l’ensemble du dispositif étant de l’ordre de 200 à 250 000 euros, auquel il faut ajouter le coût de l’intervention chirurgicale d’implantation. Ce coût rend répréhensible, pour les organismes de santé, la diffusion à large échelle de ce cœur artificiel, et ce d’autant plus s’il ne réduit que faiblement le risque d’une multi-défaillance organique à court terme chez le patient.
CARDIO 3 BIOSCIENCES, une amélioration modérée de l’insuffisance cardiaque chronique post-infarctus
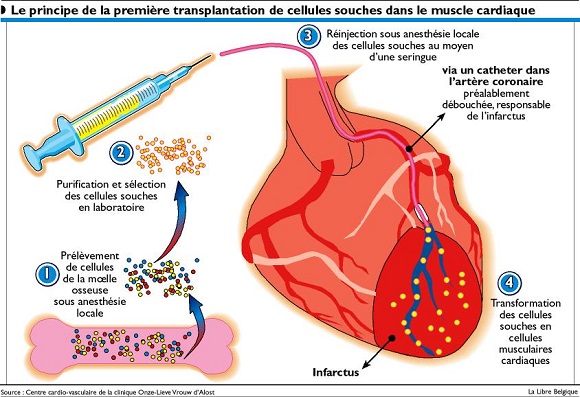
 L’approche thérapeutique de Cardio 3-Biosciences est basée sur un procédé – initialement développé et breveté par une équipe de la Mayo Clinic (USA) – de différenciation de cellules souches spécifiques, les cellules souches mésenchymateuses, présentes dans la moelle osseuse en faible quantité (1/10 000 cellules mononuclées), en progéniteurs de cellules musculaires cardiaques.
L’approche thérapeutique de Cardio 3-Biosciences est basée sur un procédé – initialement développé et breveté par une équipe de la Mayo Clinic (USA) – de différenciation de cellules souches spécifiques, les cellules souches mésenchymateuses, présentes dans la moelle osseuse en faible quantité (1/10 000 cellules mononuclées), en progéniteurs de cellules musculaires cardiaques.
A partir d’un prélèvement de moelle osseuse, effectué chez le patient en état d’ICC secondaire à un infarctus, les cellules mésenchymateuses sont isolées et purifiées, puis mises en culture pour être multipliées et différenciées en cellules souches « cardiopoïétiques » : le produit final, obtenu au bout de 22 jours, comprenant entre 600 millions et 1,2 milliard de cellules autologues, est proposé sous le nom de C-CURE.
Cardio 3 Biosciences a déjà mené à bien un essai clinique phase II, incluant 33 patients ayant fait un infarctus du myocarde (IDM) entre 6 mois et 20 ans auparavant. Ces patients ont été randomisés en deux groupes, l’un (20 patients) recevant le produit cellulaire autologue C-CURE, tandis que, dans l’autre, 13 patients continuaient simplement à recevoir leur traitement conventionnel.
La réinjection cellulaire était faite directement dans le myocarde par voie endo-ventriculaire, avec 9 à 26 points d’injection dans la zone, encore viable mais dysfonctionnelle (zone « hibernée ») entourant la lésion cicatricielle de l’infarctus, via un cathéter dédié, introduit dans l’artère fémorale. La procédure d’injection n’a été suivie d’aucun effet secondaire désagréable.
Six mois après, les patients en ayant bénéficié ont présenté une amélioration modérée, mais statistiquement significative, de leur fonction cardiaque par rapport aux données initiales, caractérisée par une augmentation de sept points en moyenne de la fraction d’éjection, une réduction des volumes ventriculaires systolique et diastolique, et une amélioration d’une soixantaine de mètres du périmètre de marche. Au contraire, dans le groupe contrôle, aucun de ces paramètres n’était amélioré.
En d’autres termes, le traitement développé par Cardio 3B, permet de ré-irriguer la zone péri-infarcie, avec pour double effet favorable d’éviter sa destruction progressivement inéluctable et d’améliorer sa fonctionnalité. Il circonscrit donc l’infarctus à sa zone primitive. Par contre, il ne semble induire aucune régénération proprement dite de la zone infarcie, sans doute pour plusieurs raisons : l’ancienneté de la lésion cardiaque, généralement fibreuse, voire même calcifiée à ce stade ; la réinjection cellulaire périphérique ; et, peut-être, l’incapacité des cellules injectées à pouvoir reconstituer un tissu cardiaque fonctionnel à partir d’une lésion théoriquement irréversible : un tel résultat n’a en effet jamais été observé à ce jour avec des cellules mésenchymateuses ou leur dérivés. Un essai Phase III multicentrique international, en cours, permettra peut-être d’y voir plus clair sur la réelle capacité régénératrice du produit C-CURE.
Pour le reste, ce processus nécessite un prélèvement de moelle osseuse, geste malgré-tout un peu désagréable pour le patient – surtout s’il est pratiqué sous anesthésie locale et non générale, et qui doit être réalisé en bloc opératoire par un médecin entraîné. Quant au coût, le traitement C-CURE est estimé par Cardio 3-Biosciences à 50 000 euros l’unité.
Enfin, le modèle d’industrialisation actuel de Cardio 3-B présente des aléas logistiques significatifs : la société ne pourra sans doute pas conserver sa production sur un seul site et devra équiper d’autres laboratoires d’expansion dans de nombreux pays afin de répondre à la demande et aux délais d’injection. Sinon, la société de biotechnologie s’avèrera très rapidement limitée dans son champ d’intervention à travers le monde, d’autant qu’elle devra respecter le cadre législatif de chaque pays pour importer ses produits médicamenteux (C-CURE).
CELLPROTHERA : Agir au plus proche de l’infarctus, en empêchant la survenue d’une insuffisance cardiaque secondaire
 L’approche thérapeutique de CellProthera est différente des deux autres, puisqu’elle traite l’infarctus au plus tôt, dans le double but de régénérer structurellement et fonctionnellement la zone myocardique lésée et, par là même, d’éviter la survenue d’une ICC secondaire, de mauvais pronostic. En outre, elle utilise un type cellulaire tout à fait différent de celui utilisé par Cardio 3-B, puisqu’il s’agit de Cellules Souches Sanguines CD34+.
L’approche thérapeutique de CellProthera est différente des deux autres, puisqu’elle traite l’infarctus au plus tôt, dans le double but de régénérer structurellement et fonctionnellement la zone myocardique lésée et, par là même, d’éviter la survenue d’une ICC secondaire, de mauvais pronostic. En outre, elle utilise un type cellulaire tout à fait différent de celui utilisé par Cardio 3-B, puisqu’il s’agit de Cellules Souches Sanguines CD34+.
La première au monde, l’équipe de l’Institut de Recherche en Hématologie et Transplantation (IRHT), dirigée par le futur fondateur de CellProthera (Professeur Hénon), avait en effet mené à partir de 2002 un essai clinique pilote dans lequel des malades atteint d’IDM sévère – trois étaient même d’emblée justiciables d’une transplantation cardiaque – recevaient une injection intracardiaque directe de cellules souches sanguines CD34+ autologues purifiées.
Les résultats au long cours de cette étude sont spectaculaires puisque six sur sept des patients inclus ont obtenu une réparation anatomique de la lésion cardiaque, clairement démontrée par PetScan, corrélée à une amélioration de plus de 70% de la fonction cardiaque. Ces six malades sont toujours vivants – y compris les trois qui étaient programmés pour une transplantation cardiaque urgente et qui l’ont évitée jusqu’à ce jour – et mènent une vie normale en ne prenant que très peu de médicaments à visée cardiaque, avec un recul allant de 7 à 11 ans depuis l’injection cellulaire.
En outre, l’équipe de l’IRHT a clairement démontré que les cellules CD34+ pouvaient se différencier en cellules cardiaques ou endothéliales, capables respectivement de « reconstituer » du tissu cardiaque et de le revasculariser, ce qui donne un sens à leur utilisation dans le domaine cardiaque.
Aujourd’hui, après quelques contestations et controverses, les cellules souches sanguines CD34+ ont le vent en poupe en thérapie cellulaire cardiaque, d’autant que la « faveur » dont jouissaient les cellules mésenchymateuses dans le domaine s’est atténuée du fait de leurs résultats « mitigés ». Plusieurs études cliniques récentes ont d’ailleurs confirmé le remarquable potentiel thérapeutique des cellules CD34+ dans le domaine cardiaque.
Ainsi, l’approche de CellProthera est de simplifier, standardiser et industrialiser la production de greffons CD34+ afin de rendre son traitement accessible au plus grand nombre de patients. A partir d’une simple prise de sang, réalisée par une infirmière chez le patient, au plus tard 15 jours après la survenue de l’IDM, les cellules CD34+ sont isolées puis multipliées (x 20 fois) pendant neuf jours dans l’automate StemXpand® développé par CellProthera. Elles gardent les mêmes caractéristiques après multiplication qu’avant, en particulier aucune modification génétique n’a été observée.
En outre, une étude préclinique, réalisée chez le rat ayant subi un IDM expérimental, a permis de valider l’effet thérapeutique indiscutable et identique des cellules avant et après multiplication, confirmant ainsi les données de l’essai clinique pilote. Les résultats de la validation biologique du processus de production automatisé développé par CellProthera sont en cours de publication. Le produit cellulaire, ainsi obtenu et labellisé sous le nom de « Protheracytes® », est considéré par les autorités comme un médicament de thérapie innovante (MTI), avec l’indication de régénérer rapidement les tissus et vaisseaux lésés et d’empêcher ainsi la survenue de l’ICC post-infarctus.
Autre différence significative avec Cardio 3-Biosciences, CellProthera a pris le parti de ne pas produire directement les greffons, mais plutôt de mettre à disposition des centres de thérapie cellulaire, déjà existants et aux normes de production pharmaceutique, les automates (StemXpand®) et équipements à usage unique (StemPack® ) assortis d’une licence d’exploitation et de production.
Cela a pour double intérêt d’éviter les investissements lourds qu’auraient entrainé la mise en place dans le futur d’unités de production disséminées dans le monde entier, et de permettre de répondre au mieux aux impératifs de délais de transport et d’injection des greffons.
Comme C-CURE, le produit cellulaire Protheracytes® sera réinjecté par le biais d’un cathéter introduit par la voie de l’artère fémorale. Par contre, le greffon cellulaire sera ici réinjecté avant la fin du 1er mois suivant l’IDM, directement dans la lésion cardiaque, et non pas autour, assurant ainsi une meilleure diffusion des cellules au sein du tissu à régénérer et donc une meilleure efficacité. L’acte d’injection par un cardiologue interventionnel pourra là aussi se faire en ambulatoire.
CellProthera estime à 25 000 euros le coût de chaque greffon, soit deux fois moins que le produit C-Cure et dix fois moins qu’un cœur artificiel Carmat.
En conclusion, ces trois thérapies de rupture présentent l’avantage d’intervenir à différents stades de l’infarctus et de l’insuffisance cardiaque, et sont donc actuellement complémentaires. Toutefois, si les résultats thérapeutiques obtenus par le procédé CellProthera confirment ceux obtenus lors de l’essai pilote et de l’étude pré-clinique, le taux d’insuffisance cardiaque secondaire à un IDM devrait considérablement baisser au fil des ans et « assécher » progressivement le marché de Carmat et de Cardio 3 Biosciences. Mais, en attendant, ces derniers ont encore quelques « bonnes » années devant eux pour traiter les insuffisants cardiaques existant déjà.
Marine Barrio – up-magazine